癌症的发病机制较为复杂,目前学界广泛接受的观点是相关基因发生突变是致癌性转变的根本原因。即在各种因素的影响下:
-
原癌基因产生突变,导致细胞无限制生长;
-
抑癌基因失活,导致细胞增殖与休眠紊乱,不能正常凋亡。
最终质变为细胞及组织水平的变异,导致癌症的发生。
所以癌症的发生和发展实际上是一个较为漫长的过程,在临床中,完全可以通过基因检测,达到早发现、早诊断、早治疗的目的。

目前,癌症相关基因检测主要基于实时荧光定量PCR(qPCR)和高通量测序(NGS)两项技术,其中qPCR具有多项技术优势:准确率高、特异性强、灵敏度高、操作简单、成本较低,被广泛应用于实验室及临床诊断中。
今天,我们就来好好聊一聊qPCR
探针法qPCR 技术原理:
qPCR依据检测原理不同,分为染料法和探针法。探针法qPCR需针对目的基因设计特异性引物与特异性荧光探针,探针的5’端标记一个荧光报告基团(Reporter,如FAM、VIC、HEX等),3’端标记一个荧光淬灭基团(Quencher,如TAMRA、BHQ1等)。
-
当荧光探针保持结构完整时,探针与模板退火结合,其特异性结合位点位于正反两条引物之间。5’端报告基团受仪器光源激发的荧光正好被近距离的3’端淬灭基团淬灭,仪器检测不到5′端报告基团所激发的荧光信号。
-
随着扩增进行,DNA聚合酶在延伸过程中遇到与模板结合的探针,因其双链特异性的5’-3’外切酶活性,就会切割荧光探针,释放5’端报告基团游离于反应体系中,远离3’端淬灭基团,此时5’端报告基团受激发所产生的荧光信号就可以被仪器检测到。每扩增一条DNA链,就有一个游离的荧光分子形成,荧光信号的强弱与扩增产物量成正比,最终通过数据分析实现对初始模板的定量。
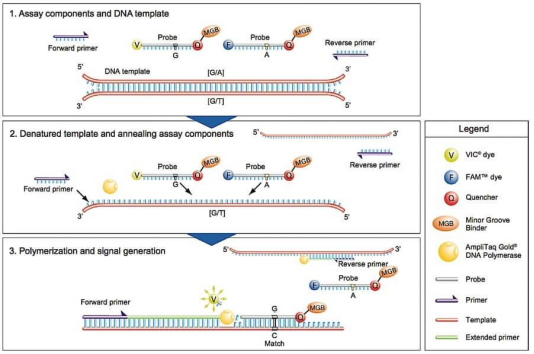
图1. 探针法qPCR技术原理示意图
作为一种有效的癌症筛查检测及伴随诊断技术,探针法qPCR涉及领域涵盖癌症的预防与治疗。这项技术不但能有效地检测到基因的突变,还可以准确检测相关基因的表达量。
qPCR应用于癌症筛查
探针法qPCR目前已广泛应用于多种癌症相关基因的表达检测,包括:
-
端粒酶hTERT基因
-
慢性粒细胞性白血病WT1基因
-
肿瘤ER基因
-
前列腺癌PSM基因
-
宫颈癌相关病毒HPV
-
……
其中女性高发恶性肿瘤之一的宫颈癌,早期发现并及时治疗,可以达到非常好的疗效,治愈率在90%左右。目前已证实高危人乳头瘤(HPV)病毒持续感染与宫颈癌有着密切联系,因此,对于高危HPV病毒的专项检测,已成为宫颈癌筛查的重要手段。高危HPV病毒核酸检测与细胞学联合筛查被越来越多的应用于临床。
图2. 高危HPV病毒核酸检测与细胞学联合筛查可有效降低漏诊率
qPCR应用于抗癌药物研发
除此之外,探针法qPCR还可应用于抗癌药物的研发。在新药的开发过程中,快速了解药物对癌症进程的影响可以为新药开发节约大量的人力、时间和资金。
与Elisa等方法相比,探针法qPCR技术可以快速、准确、灵敏地测定血液或组织中目的基因的表达量,为比较不同配方的疗效、用药量、用药时间等,提供快速、准确的评价。
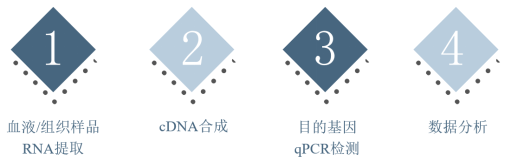
图3. qPCR检测流程示意图
手把手实验教学
p53是重要的抑癌基因,几乎参与所有癌症的发生与发展,其编码蛋白有促使损伤DNA修复、损伤细胞凋亡从而防止癌变的功能。
假设现在有两种配方药物,分别加入细胞培养液中,看不同配方药物对p53 mRNA水平的影响,应该怎样来设计实验以及分析结果呢?
实验设计:
分别种三皿细胞,一皿加入配方一药物,另外一皿加入配方二药物,剩下一皿加入对照。处理一段时间之后,分别收集细胞并提取RNA,再进行反转录,以反转录得到的cDNA为模板进行qPCR。qPCR如下图所示进行加样:
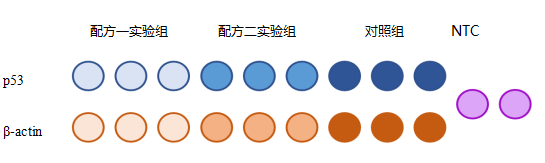
图4. qPCR加样示意图
注意区分 “技术重复”和“生物学重复”这两个概念,图4中p53和β-actin每个实验组和对照组都各有三个qPCR复孔,这是技术重复,目的是消除本次实验的操作误差。生物学重复指的是做三次独立的重复试验,目的是消除组内误差、提高结果的可靠性。在本例中,就要求在其他时间另外再种三皿细胞,再分别处理后提取RNA,接着再做反转录和qPCR,如此做了三次独立重复实验之后才能算作三次生物学重复,统计误差的来源应该包括生物学重复和技术重复。
做完上述实验之后,假设得到结果如下:

表1. Test1 Ct值结果
再做两次独立重复实验,假设得到结果如下:

表2. Test2 Ct值结果
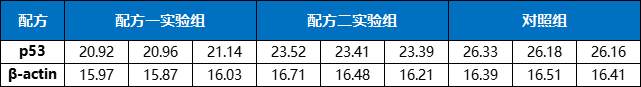
表3. Test3 Ct值结果
结果分析:
下表为完整计算过程(ΔCt=Ct p53-Ct β-actin;ΔΔCt=ΔCt实验组-ΔCt对照组):
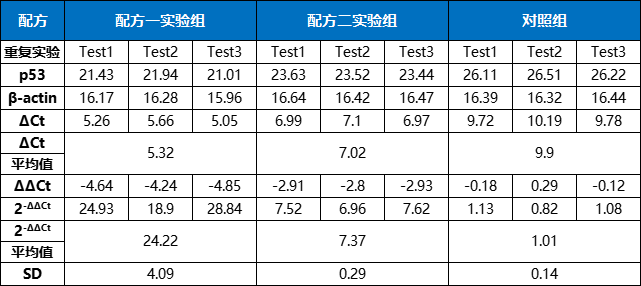
表4. 相对表达量计算方法示例
整理一下数据(相对表达量平均值=2-ΔΔCt平均值):

表5. p53相对表达量数据
就可以生成p53 mRNA水平的相对表达量柱形图了:

图5. p53 mRNA水平相对表达量柱形图
到这里,离获得实验结论只有一步之遥。还需要确定实验组与对照组之间是否存在显著性差异。
首先需要确定的是,用什么方法来进行检验?
因为各实验组与对照组之间毫无相关存在,所以应该采用独立样本t检验的方法。可以使用SPSS统计软件来统计P值,也可以直接使用Excel软件来进行t检验。
-
P<0.05代表存在显著性差异
-
P<0.01代表存在极显著差异
-
在本例中,配方一实验组P值<0.01,配方二实验组P值
-
配方一药物处理极显著提高了p35 mRNA水平的表达。
-
配方二药物处理显著提高了p35 mRNA水平的表达。
总结:
需要强调的是,本文例举的方法只适用于单因素处理的比较,该因素(本例中为加药)处理得到的结果应当是稳定的。在本例中,即表示在相同细胞中加相同浓度的相同配方药物,p53 mRNA的变化水平应当是一致的。
探针法qPCR能够快捷地提供更加客观、精确的基因定量检测结果,对高发癌症的普查和诊断、相关药物的研发具有重要意义。
但这项技术也存在假阳性导致过度诊断的问题,可采用探针法qPCR同时检测多个相关基因,或与其他一些技术如细胞学检测等结合应用,进行综合性指标分析。
康润生物(GenStar) 探针法qPCR试剂
重点产品推荐
2×RealStar Fast探针法qPCR预混液(Cat#A351)
-
易检:灵敏度更高,适合低拷贝基因,易检出。
-
更快:预混型一管化设计,使用方便;可进行多重检测,一次检出多个基因。
-
更稳:重复性好,产品性能稳定。
-
更准:采用抗体型修饰热启动酶,特异性好,结果更准确。
-
更低:性价比高,实验成本更低。
相关产品信息





