无缝克隆是一种新型基因克隆技术,它可以同时将1到多个片段高效的插入到任何载体。目前应用较广泛的无缝克隆方法是Gibson Assembly和In-Fusion Cloning。这两种方法的在原理上非常相似:都是通过外切酶产生黏性末端、然后利用体内或体外重组酶进行连接,得到重组片段;但两者用到的酶却完全不同。我们一起来了解无缝克隆的秘密。
Gibson Assembly原理
Gibson Assembly是由Daniel Gibson和J.Craig Venter在2009年提出的。Gibson Assembly要求目的片段与线性化载体首尾具有一段互补重叠的同源臂序列;利用T5 exonuclease的5’一3’外切酶活性产生3’黏性末端,之后同源臂进行互补配对,再利用DNA polymerase延伸补齐片段上的缺口部分,最后通过Taq DNA Ligase连接DNA片段中的缺刻,完成克隆组装。
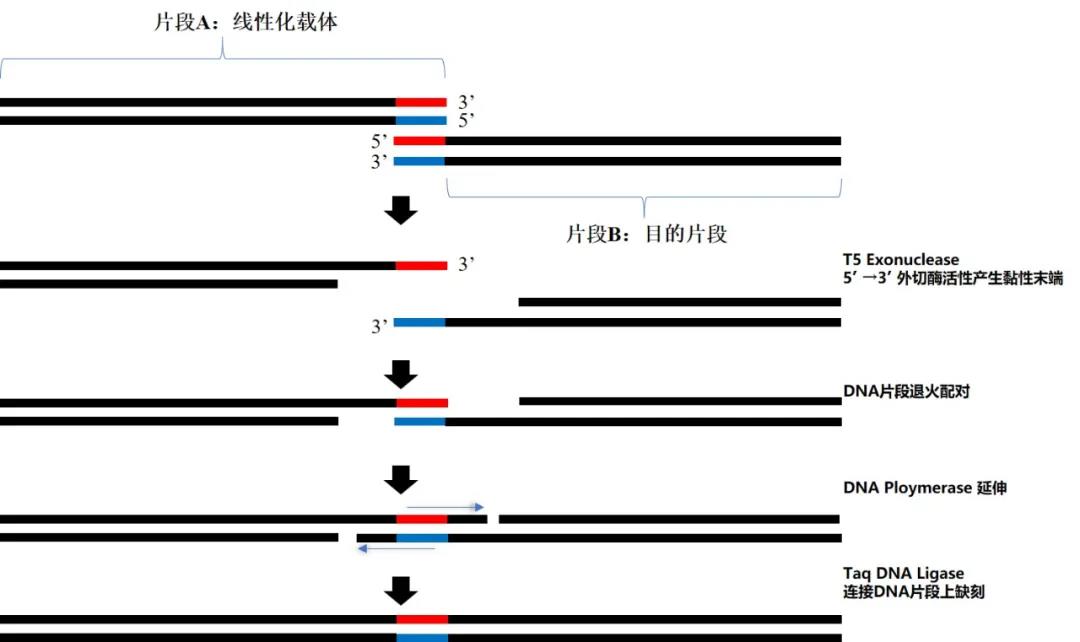
Gibson Assembly原理示意图
In-Fusion Cloning原理
In-Fusion Cloning利用了In-Fusion酶能够识别3’末端碱基,具有3’→5’外切酶活性的特点。通过In-Fusion酶产生5’黏性末端,互补重叠片段退火配对;再将重组片段转化到感受态细胞内,重组片段序列中的缺刻在菌体内进行连接,获得重组序列。
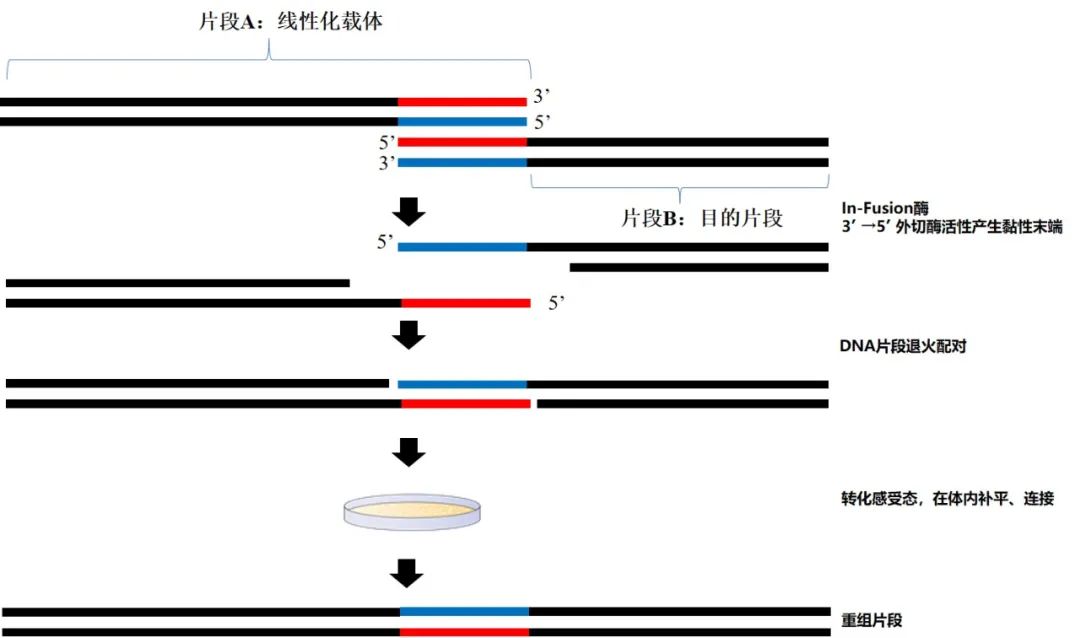
In-Fusion Cloning原理示意图
无缝克隆的优势
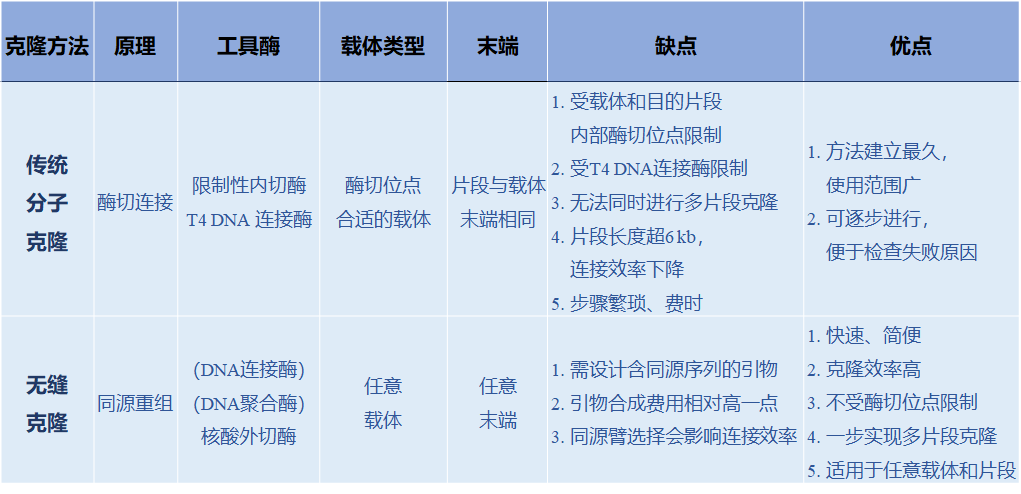
传统的分子克隆技术依赖于Ⅱ型限制性内切酶和T4 DNA连接酶的使用,DNA片段与载体经相同的限制性内切酶切割产生相同的末端,然后利用T4 DNA连接酶反应实现片段融合。这种方法受到酶切位点限制,需选择片段与载体序列内部没有、而仅在载体多克隆位点存在的酶切位点。酶切连接的方法一次只能连接单个片段,无法实现多片段同时连接。且该方法中T4 DNA连接酶的辅助因子ATP易失活,影响克隆效率。无缝克隆与传统的酶切连接相比,具有以下优势:
-
不受酶切位点限制
-
适用于任意载体、任意片段
-
一步连接1或多个片段,连接多片段耗时短
-
插入目的片段两端不会添加额外序列(如保护碱基)
无缝克隆实验关键影响因素
自无缝克隆技术被大家认识后,得到了众多老师的青睐,但同时也有部分质疑:连接效率为何总是不尽如人意?我们来细数影响无缝克隆实验的关键因素有哪些?
无缝克隆实验流程
片段质量
-
确保DNA片段无核酸酶及其它酶污染、无乙醇等残留;
-
纯度正常:A260/A280值在1.6-1.9、A260/230值在2左右、紫外吸收峰图正常;
-
浓度正常:插入片段与线性化载体浓度高于50 ng/μl,会使重组效率提高;
-
若模板浓度低、纯度低,则连接效率降低。
载体线性化方法
线性化载体可以选择反向PCR或酶切的方法:
-
可根据在载体插入位置是否有合适的酶切位点选择具体方法。因Gibson Assembly反应体系内无双链DNA连接酶,不会发生载体自连,线性化载体不需要进行末端去磷酸化处理。酶切制备线性化载体建议使用双酶切,且酶切后采用胶回收的方法回收产物,这样利于降低假阳性。
-
若没有合适酶切位点或者多次酶切制备线性化载体均不成功,可以选择反向PCR扩增,但不适合较大质粒,如超过8 kb。
引物设计
-
目的片段引物设计:目的片段引物是由目的片段两端序列加同源臂序列组成,同源臂长度设置在16-45 bp,Tm值在58–65°C。同源臂越长,有利于重组置换,但可能会影响目的片段扩增;
-
载体引物设计:确定目的片段插入位置,推荐借助Snapgene软件设计反向PCR引物。
PCR扩增
-
反向PCR制备线性化载体及扩增目的片段时需要使用高保真酶;
-
制备线性化载体后使用Dpn I内切酶消化环状质粒模板,降低假阳性克隆。
插入片段与线性化载体摩尔比
-
10 µl 反应体系,载体与插入片段总加入量建议在 0.01-0.3 pmol。插入片段与线性化载体的最佳摩尔比为 1:1-4:1;片段与片段的摩尔比为1:1。
-
推荐使用GenStar 克隆连接反应体系计算工具,快速计算载体与目的片段使用量。
感受态转化效率
-
插入片段与载体全长超过10 kb,属于长片段克隆,应使用高效感受态;如:转化效率大于108 cfu/μg DNA的感受态细胞。
-
感受态细胞与重组质粒用量比例不小于10:1。
只要注意以上几点,高效无缝克隆实验轻松get。
什么?不清楚无缝克隆实验具体怎样操作?
点击下方链接,查看GenStar完整版无缝克隆实验操作视频,带你迅速掌握无缝克隆技术!
https://www.gene-star.com/videos_cont_154.html#coming




